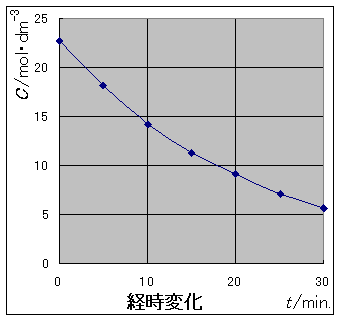
過酸化水素の分解を研究していた J.von Bertalan(1920)は,過酸化水素の濃度と時間の関係を発見しました。
微分方程式は,以下のように示されます。
![]() (2)
(2)
v:分解速度 t:時間 C:反応時間t における過酸化水素の濃度
dC/dt は,反応の速度を表しています。(2)式から明らかなように,反応の速度は濃度と比例の関係にあります。
比例定数k は,一次の反応速度定数といいます。kは,触媒の量や反応温度にも依存します。
反応速度実験では,過酸化水素の分解反応が(2)式に従うのかどうか,実験データをもとに検証してもらいます。
(2)式では,両辺に濃度C があるので,発展性のある積分形へ展開します。![]()
積分形への展開の仕方が分からないときは・・・ ![]()