鉄ミョウバンによる過酸化水素の分解反応実験
過酸化水素の反応は次式のように行われます。
H2O2→ H2O + 1/2 O2
Fe3+
化学反応が起こるとき,反応物の物質量(濃度)は時間とともにどのように変化するでしょう。
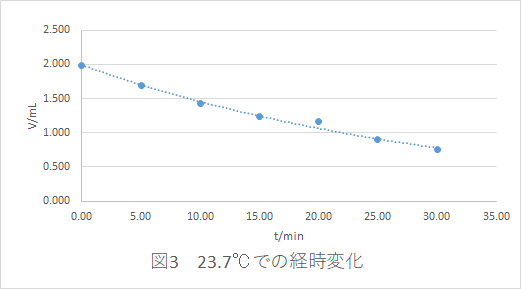
この変化(経時変化といいます)を測定することは,反応速度実験の 第 1歩です。
過酸化水素の分解を研究していたJ.von Bertalan(1920)は,過酸化水素の濃度と時間の関係を発見しました。
微分方程式は次のように示されます。
v= -dC/dt=kC (2)
V:分解速度 t:時間 C:反応時間tにおける過酸化水素の濃度
dC/dtは反応の速度を表しています。
(2)式から明らかなように,反応の速度は濃度と比例の関係にあります。
比例定数kは一次の反応速度定数といいます。
kは触媒の量や反応温度にも依存します。
反応速度実験では,過酸化水素の分解反応が(2)式に従うのかどうか実験データを基に検証してもらいます。
(2)式では両辺に濃度Cがあるので,発展性のある積分形へ展開します。
ln(C0/C)=kt (3)
C0 :反応開始時の過酸化水素の濃度(初濃度)
測定値Vは濃度Cに比例するので、X軸にt,Y軸にln(C0 /C)をプロットすると, 原点を通る傾きkの直線 が見いだされます。
この直線からtとln(C 0 /C)の間に比例の関係 があるといえるのです。
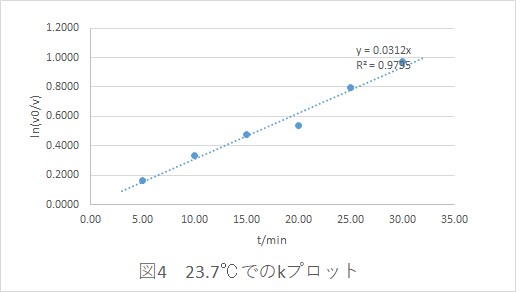
このグラフのことを「 一次反応のk-プロット 」または「 k-プロット 」と呼ぶことにします。
では実験を行うと本当に比例関係になるのでしょうか?
反応速度実験では,(2)式を展開した(3)式を用い,実験データが「比例の関係である」といえるのか判定してもらいます。
比例の関係の証明には
1, 直線性を見出せるか
2, その直線は原点を通るとみなせるか
の2項目を判断基準に用います。
次 実験操作>>